Η νόσος του Alzheimer προκαλείται από εμπλοκές στον εγκέφαλο που διαμορφώνονται από προβληματική εναπόθεση των πρωτεϊνών TAU. Επιστήμονες στο EPFL ανακάλυψαν μια νέα τοξική μορφή της πρωτεΐνης TAU που σχηματίζεται ως αποτέλεσμα της αλληλεπίδρασής της με κυτταρικές μεμβράνες. Η έρευνα που δημοσιεύεται στο Nature Communications παρέχει νέες γνώσεις δυνατών μηχανισμών με τους οποίους η πρωτεΐνη αυτή κινείται στον εγκέφαλο και σκοτώνει τους νευρώνες.
Οι εγκέφαλοι των ασθενών με τη νόσο του Alzheimer περιέχουν χαρακτηριστικές εμπλοκές μέσα στους νευρώνες. Οι εμπλοκές αυτές σχηματίζονται όταν μια πρωτεΐνη που ονομάζεται TAU συγκεντρώνεται σε συνεστραμμένες λεπτές ίνες (ινίδια). Αποτέλεσμα: τα συστήματα μεταφοράς των νευρώνων αποικοδομούνται, ουσιώδη θρεπτικά συστατικά δεν μπορούν να κινηθούν δια μέσου αυτών και τα κύτταρα αρχίζουν να πεθαίνουν, επηρεάζοντας τις λειτουργίες του εγκεφάλου και οδηγώντας στην ανάδυση των συμπτωμάτων της νόσου.
Δεδομένου του ρόλου της στην παθολογία της νόσου του Alzheimer, η πρωτεΐνη TAU έχει ερευνηθεί εκτεταμένα. Με διάφορες κλινικές δοκιμές θεραπειών που στοχεύουν την αμυλοειδή (β-αμυλοειδής πρωτεΐνη) να αποτυχαίνουν πρόσφατα, η TAU έγινε ένας από τους πιο δραστήρια επιδιωκόμενους θεραπευτικούς στόχους για τη νόσο του Alzheimer. Ωστόσο, παραμένουν ακόμη ερωτήματα σχετικά με το πώς εξαπλώνεται η TAU στον εγκέφαλο και σκοτώνει τους νευρώνες. Η μεμβράνη του κυττάρου φαίνεται να παίζει ρόλο στη ρύθμιση των ιδιοτήτων συσσώρευσης της TAU και στις φυσιολογικές της λειτουργίες, όμως ακόμη δεν κατανοούμε πώς η αλληλεπίδραση μεταξύ TAU και λιπιδικών μεμβρανών μπορούν να οδηγήσουν στην απώλεια των νευρώνων που εμφανίζεται στην νόσο του Alzheimer.
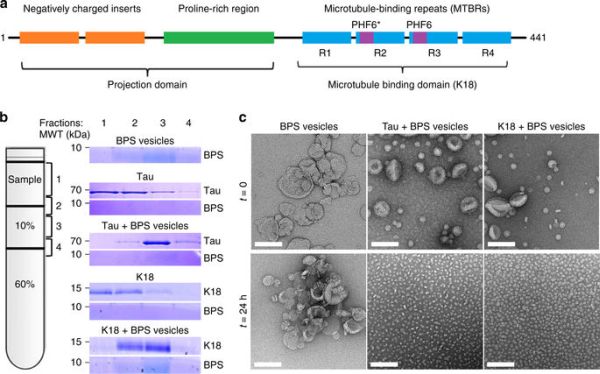
Τώρα, το Εργαστήριο του καθ. Hilal Lashuel στο EPFL (Ecole Polytechnique Fédérale de Lausanne), σε συνεργασία με το Εργαστήριο του Thomas Walz στο Πανεπιστήμιο Rockefeller, βρήκαν ότι μεμονωμένες πρωτεΐνες TAU αλληλεπιδρούν και διασπούν τις κυτταρικές μεμβράνες των νευρώνων. Η διάσπαση αυτή αποτελεί έναυσμα για πολύ σταθερά σύμπλοκα που διαμορφώνονται από διάφορες πρωτεΐνες TAU καθώς και μόρια λίπους (φωσφολιπίδια) από τη μεμβράνη.
Μεταγενέστερες μελέτες έδειξαν ότι τα σύμπλοκα πρωτεΐνης/φωσφολιπιδίου είναι περισσότερο εύκολα να δεσμεύονται από τους νευρώνες, σε σύγκριση με την μορφή ινιδίου της πρωτεΐνης και επάγουν τοξικότητα σε βασικούς νευρώνες του ιππόκαμπου in vitro. Ο ιππόκαμπος είναι εκεί όπου γίνεται η επεξεργασία της μνήμης και η απώλεια των ιπποκάμπιων νευρώνων είναι ένα κλασικό σύμπτωμα της νόσου του Alzheimer. Τα σύμπλοκα ανιχνεύθηκαν με ένα αντίσωμα (MC-1) που χρησιμοποιείται ως πρότυπο για την ανίχνευση παθολογικών διαμορφώσεων της TAU, που σημαίνει ότι μοιράζονται ορισμένα χαρακτηριστικά της παθολογικής μορφής της πρωτεΐνης.
«Στόχος μας ήταν να εντοπίσουμε την σειρά και τους δομικούς παράγοντες που οδηγούν την αλληλεπίδραση της TAU με μεμβράνες και το σχηματισμό αυτών των σύμπλοκων, έτσι που να μπορέσουμε να αναπτύξουμε στρατηγικές για να επέμβουμε στο σχηματισμό και να μπλοκάρουμε την τοξικότητά τους», λέει η Nadine Ait Bouziad, που ηγείται της μελέτης. Σε συνεργασία με τον καθηγητή Eliezer στην Weill Cornell School of Medical Sciences, οι ερευνητές χρησιμοποίησαν Πυρηνικό Μαγνητικό Συντονισμό (NMR) για να διεισδύσουν στη δομή της TAU και στον πυρήνα των σύμπλοκων. Αυτό αποκάλυψε ότι οι πυρήνες αποτελούνται από δυο μικρά πεπτίδια, το καθένα με μήκος μόνο έξι αμινοξέα. Τα πεπτίδια αυτά, που ονομάζονται PHF6* και PHF6 και παίζουν σημαντικούς ρόλους στην ώθηση της συγκέντρωσης της TAU και της συναρμολόγησης σε ινίδια. Η παρουσία τους συνδέει τα σύμπλοκα πρωτεΐνης/φωσφολιπιδίου με την εξέλιξη της νόσου του Alzheimer.
Οικοδομώντας στα ευρήματά τους, οι ερευνητές μπόρεσαν να παραγάγουν μεταλλαγμένη πρωτεΐνη TAU. Ο εισαγόμενες μεταλλάξεις διέκοψαν την ικανότητα της TAU να αλληλεπιδρά με τις κυτταρικές μεμβράνες, αλλά χωρίς να παρεμβαίνουν στην ικανότητα να διαμορφώνουν ινίδια. Η ιδέα πίσω από αυτό είναι ότι τέτοιες μεταλλάξεις μπορεί να χρησιμοποιηθούν για να αποσυνδεθούν αυτές οι δυο διαδικασίες, πράγμα που θα επιτρέψει τους ερευνητές να ερευνήσουν την επίδραση που έχουν αυτές οι αλληλεπιδράσεις με τη μεμβράνη στη λειτουργία, τη συσσώρευση και την τοξικότητα της TAU σε καλλιέργειες βασικών νευρώνων. Αυτό θα είναι ένα πρώτο βήμα στην απόκτηση μιας πιο καθαρής εικόνας του πώς η εμπλοκή της TAU αρχίζει να διαμορφώνεται, πράγμα που θα μπορούσε να είναι κρίσιμο για το εάν θα αναπτύξουμε αποτελεσματικές θεραπείες για να εξουδετερώσουμε την τοξικότητά τους.
«Τα ευρήματά μας στοχεύουν σε μια νέα μορφή συμπλόκων πρωτεΐνης TAU/φωσφολιπιδίων που μπορεί να είναι μέρος για ένα εξαρτημένο από τη μεμβράνη μηχανισμό που ρυθμίζει τη δομή της TAU, τον ολιγομερισμό, την τοξικότητα και πιθανά την κανονική και αποκλίνουσα διακίνηση μεταξύ και εντός των νευρώνων», αναφέρει ο Hilal Lashuel. «Αναπτύσσοντας εργαλεία που μας επιτρέπουν να ανιχνεύσουμε, να διασπάσουμε και/ή να στοχεύσουμε αυτά τα σύμπλοκα, ελπίζουμε να προσδιορίσουμε νέες στρατηγικές για να περιορίσουμε την συσσώρευση, την τοξικότητα και την παθολογία της εξάπλωσης της TAU στον εγκέφαλο με Alzheimer».
Περισσότερα στη δημοσίευση: Discovery and Characterization of Stable and Toxic Tau/Phospholipid Oligomeric Complexes. Nature Communications.
Όλες οι σημαντικές και έκτακτες ειδήσεις σήμερα
ΕΟΠΥΥ: Πώς θα πάρετε το «άγνωστο» επίδομα των 900 ευρώ
Voucher 750 ευρώ σε εργαζόμενους του ιδιωτικού τομέα - Ανοίγουν οι αιτήσεις


 Alfavita Newsroom
Alfavita Newsroom